

近日,清華大學(xué)附屬北京清華長庚醫(yī)院閆軍副教授團(tuán)隊聯(lián)合天津大學(xué)生命科學(xué)院康君副教授團(tuán)隊,成功研發(fā)了一種腫瘤微環(huán)境響應(yīng)型鈦基納米聲納增敏劑CaPT,該研究融合了聲動力治療和免疫療法,采用鈣離子過載技術(shù),為患者提供了更精確、有效的治療選擇,為肝膽腫瘤治療帶來了新希望。
該研究成果發(fā)表于工程技術(shù)與化學(xué)化工領(lǐng)域最有影響力的三大頂級刊物之一Chemical Engineering Journal中。
肝膽腫瘤難以早期發(fā)現(xiàn),腫瘤內(nèi)存在的乏氧細(xì)胞又導(dǎo)致它對放射治療的抗拒,一直以來都是醫(yī)學(xué)界的難題。該研究的關(guān)鍵在于一種特殊的納米聲納增敏劑CaPT,其以鉑-二氧化鈦納米顆粒為內(nèi)核,酸響應(yīng)的碳酸鈣為殼層。
當(dāng)CaPT暴露到酸性腫瘤微環(huán)境時,碳酸鈣殼層發(fā)生分解,游離的鈣離子引起腫瘤細(xì)胞內(nèi)鈣過載。在超聲激發(fā)下,該藥物不僅可以促進(jìn)二氧化鈦中電子和空穴的分離進(jìn)而增強(qiáng)活性氧產(chǎn)量,而且可以催化腫瘤組織中的過氧化氫產(chǎn)生氧氣,緩解腫瘤的乏氧,為聲動力治療提供足夠的氧源。此外,碳酸鈣分解引起的細(xì)胞內(nèi)Ca2+過載進(jìn)一步放大氧化應(yīng)激和誘導(dǎo)腫瘤細(xì)胞發(fā)生免疫原性死亡,最終實現(xiàn)腫瘤聲動力聯(lián)合免疫治療。
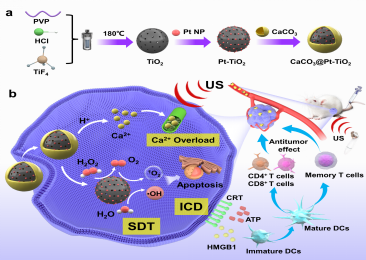
CaPT將納米技術(shù)、聲動力治療和免疫療法融為一體,能夠根據(jù)肝癌腫瘤微環(huán)境的變化自動釋放,提高聲動力治療的精確性和有效性,不僅可以精確定位腫瘤細(xì)胞,還可以在聲動力治療過程中釋放鈣離子,誘導(dǎo)腫瘤細(xì)胞凋亡。此外,這種納米聲納增敏劑還能激活患者的免疫系統(tǒng),增強(qiáng)免疫細(xì)胞對肝癌腫瘤細(xì)胞的攻擊力。研究結(jié)果顯示,采用腫瘤微環(huán)境響應(yīng)型鈦基納米聲納增敏劑的小鼠,肝癌腫瘤縮小的速度更快,副作用更少,具有廣泛地臨床應(yīng)用前景。
該研究成果以A Tumor Microenvironment Responsive Titanium-Based Nanosonosensitizer for Combination Sonodynamic-Immunotherapy with Calcium Ion Overload為題,北京清華長庚醫(yī)院醫(yī)院肝膽胰外科副主任醫(yī)師、清華大學(xué)副教授閆軍,天津大學(xué)教授常津、副教授康君為本文的共同通訊作者,天津大學(xué)生命科學(xué)學(xué)院湯聰和徐州中心醫(yī)院李歡送為本文的共同第一作者。
該研究成果有望在不久的將來進(jìn)入臨床試驗階段,為醫(yī)學(xué)領(lǐng)域帶來積極變革,助力肝膽腫瘤患者早日戰(zhàn)勝疾病,重返健康生活。

北京清華長庚醫(yī)院APP
快速掛號